Il PH
In chimica, al fine di quantificare la basicità o l'acidità di una soluzione, si utilizza un numero reale che tenga conto della concentrazione degli ioni H+ in essa presenti. Questi ioni, normalmente, sono in quantità molto piccola e vengono indicati, usando le parentesi quadre per simboleggiare le concentrazioni molari, attraverso espressioni del tipo: [H+] = 10-5 mol/L, il che significa che in un litro di soluzione vi è un centomillesimo di mole di ioni H+.
Per semplificare di molto i calcoli si fece riferimento al solo esponente del valore della concentrazione, anziché a tutto il numero, quindi si decise di chiamare questo esponente pH, dove p sta per potenza del 10 e H sta per ione idrogeno. Tale numero viene definito come l'opposto del logaritmo, in base 10, della concentrazione molare degli ioni idrogeno ed è espresso dalla relazione matematica:
pH=−log[H+].
La scala dei valori del pH va da 0 a 14.
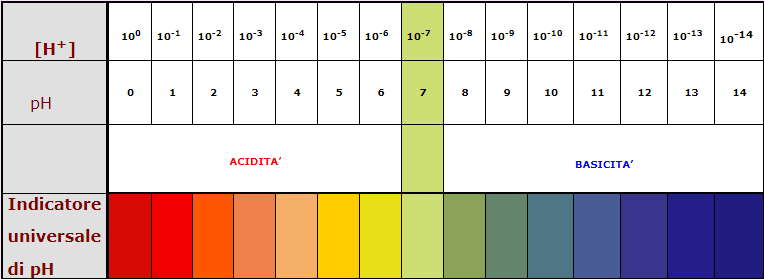 Essendo una scala logaritmica, se si passa da un "gradino" ad un altro la concentrazione degli ioni H+ varia di 10 volte. Quando il valore del pH di una soluzione è minore di 7, essa si dice acida; quando è maggiore di 7, essa si dice basica; se il pH è uguale a 7, la soluzione si dice neutra, ad esempio il pH neutro è quello dell’acqua distillata mantenuta alla temperatura di 25 °C.
Essendo una scala logaritmica, se si passa da un "gradino" ad un altro la concentrazione degli ioni H+ varia di 10 volte. Quando il valore del pH di una soluzione è minore di 7, essa si dice acida; quando è maggiore di 7, essa si dice basica; se il pH è uguale a 7, la soluzione si dice neutra, ad esempio il pH neutro è quello dell’acqua distillata mantenuta alla temperatura di 25 °C.
L’acqua distillata è un’acqua quasi completamente pura, priva di sali minerali, gas e batteri, che normalmente arricchiscono l’acqua in proporzioni diverse, a seconda della sua provenienza (sorgente, rubinetto, bottiglia, mare, ecc). Quest’acqua presenta una conducibilità elettrica più bassa dell'acqua di uso quotidiano a causa di una più bassa concentrazione di ioni al suo interno.
L’acqua di uso comune conduce corrente elettrica, ciò significa che nell’acqua sono presenti degli ioni, anche se in concentrazione molto limitata che permettono il passaggio di corrente elettrica. Per indicare l’equilibrio tra le pochissime molecole ionizzate si utilizza una costante di equilibrio detta anche prodotto ionico dell’acqua, espresso dalla formula Kw= [H+] x [OH-]; alla temperatura di 25° C, il suo valore costante è uguale a 1,0 x 10-14.
Il pH della pelle, a differenza di quanto si potrebbe intendere da alcune pubblicità, non è neutro ma è leggermente acido, ciò non è casuale ma ha una ragione ben precisa: in questo modo infatti la pelle riesce ad assolvere al meglio al proprio ruolo di difesa dalla proliferazione dei microrganismi pericolosi come ad esempio gli agenti patogeni.
Per la misurazione del pH di una soluzione, viene utilizzata una speciale cartina, detta cartina al tornasole, avente degli indicatori universali che restituiscono solo valori interi del pH, inoltre, esiste uno strumento, detto pH-metro (piaccametro), che è costituito da una sonda da inserire all'interno della soluzione di cui si vuole misurare il pH, collegata ad un apparecchio con un display sul quale leggere il valore.
| Bevanda | pH |
| Coca Cola | 2,5 |
| Vino bianco | 2,8 |
| Limonata | 3 |
| Vino rosso | 3,3 |
| Succo di mela | 3,5 |
| Succo d'uva | 4 |
| Birra | 4,2 |
| Whisky | 4,3 |
| Latte | 6,5 |
Nel seguente file di GeoGebra è possibile determinare il valore del pH (da 8 a 14) inserendo il valore della concentrazione (valore minimo possibile 10-8=0.00000001) nel campo d'inserimento anche utilizzando la notazione esponenziale (ad esempio con la seguente sintassi 3.16*10^(-4) per avere 0.000316) o variare il punto sullo slider per visualizzare come varia il PH al variare della concentrazione.
Questo articolo è sotto la licenza Licenza Creative Commons Attribution Non-commercial No Derivatives 3.0